Primeira vacina experimental dos EUA contra covid-19 entra em fase final de testes
A farmacêutica americana Moderna começou nesta segunda-feira (27/07) a terceira e última fase de testes de uma vacina experimental contra a covid-19, com a participação de 30 mil voluntários. A empresa, que recebeu quase 1 bilhão de dólares do governo americano para financiar o projeto, é a primeira do país a entrar na fase final de testes.
De acordo com o diretor executivo da Moderna, Stéphane Bancel, os dados "alentadores" da primeira fase levam a empresa a pensar que é possível "ajudar a lidar com a pandemia e prevenir futuros surtos".
Os voluntários receberão aleatoriamente doses de 100 microgramas de um placebo ou do fármaco, com o objetivo principal de comprovar se este é capaz prevenir os sintomas de covid-19, a infecção pelo coronavírus e os casos graves. Segundo a empresa, as primeiras doses foram aplicadas em Savannah, Geórgia, um dos mais de 70 locais de teste espalhados pelos Estados Unidos.
Os voluntários não saberão se estão recebendo a vacina real ou o placebo. Após duas doses, os cientistas acompanharão qual grupo foi mais infectado, à medida que os participantes sigam suas rotinas diárias, especialmente em áreas onde o vírus ainda está se alastrando descontroladamente.
A fase 3 de testes, com um número alto de voluntários, só foi possível graças a novos repasses de verbas do governo americano. No domingo, a Moderna anunciou em comunicado que conseguiu dobrar o financiamento governamental do projeto para US$ 955 milhões, modificando o contrato com a Autoridade de Pesquisa e Desenvolvimento Avançado de Biomedicina (Barda, na sigla em inglês) para ampliar em US$ 472 milhões a quantia inicial destinada ao desenvolvimento da vacina mRNA-1273.
"Após conversas com a Administração de Alimentos e Fármacos (FDA) e com a Operação Warp Seed nos últimos meses, a empresa decidiu executar uma terceira fase do teste clínico significativamente maior, fechando uma lacuna no financiamento da Barda graças a esta modificação no contrato", explicou a empresa.
A Moderna comunicou que, ao iniciar nesta segunda-feira a terceira fase do teste, dirigido pelo Instituto Nacional de Alergias e Doenças Infecciosas dos EUA, se torna a primeira empresa da corrida americana pela vacina a entrar nesta etapa avançada. Ela disse que continua a caminho de poder fornecer cerca de 500 milhões de doses da vacina em 2020, e possivelmente até 1 bilhão de doses por ano a partir de 2021.
Os Estados Unidos já registraram 4,2 milhões de casos de covid-19 e mais de 146 mil mortes, segundo estatística independente realizada pela Universidade Johns Hopkins.
Em todo o mundo, outras quatro candidatas à vacina estão na fase 3 de estudos clínicos: três da China e uma do Reino Unido de acordo com um balanço da Organização Mundial de Saúde (OMS).
Na terceira semana de julho, voluntários brasileiros começam a testar a vacina desenvolvida pela empresa chinesa Sinovac Biotech. Os primeiros 890 participantes receberam doses no Hospital das Clínicas da Faculdade de Medicina da USP, em parceria com o Instituto Butantan de São Paulo. Os pesquisadores do hospital vão analisar os voluntários a cada duas semanas, e estima-se que as primeiras análises estarão concluídas em até três meses. No total, participarão dessa fase 9 mil voluntários brasileiros, todos profissionais da saúde.
Além da vacina chinesa, o Brasil também está participando da fase 3 da vacina experimental desenvolvida pela Universidade de Oxford e a empresa farmacêutica AstraZeneca. De acordo com resultados preliminares divulgados recentemente, ela é segura e induziu resposta imunológica, segundo resultados preliminares divulgados na semana passada. A terceira fase de estudos clínicos, que inclui testes em 50 mil pessoas, está em andamento e inclui testes em 5 mil voluntários brasileiros, feitos em parceria com a Universidade Federal de São Paulo (Unifesp).
Fonte: DW
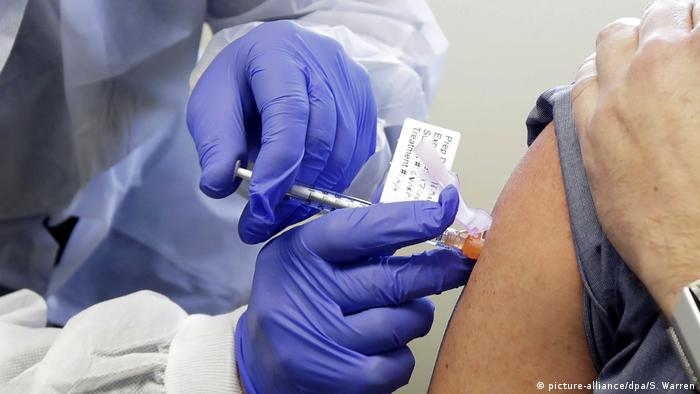
No total, 30 mil voluntários participarão dos estudos
clínicos de fármaco desenvolvido pela empresa Moderna. Governo americano
investiu quase 1 bilhão de dólares no projeto.
DW
27.07.2020
A farmacêutica americana Moderna começou nesta segunda-feira (27/07) a terceira e última fase de testes de uma vacina experimental contra a covid-19, com a participação de 30 mil voluntários. A empresa, que recebeu quase 1 bilhão de dólares do governo americano para financiar o projeto, é a primeira do país a entrar na fase final de testes.
De acordo com o diretor executivo da Moderna, Stéphane Bancel, os dados "alentadores" da primeira fase levam a empresa a pensar que é possível "ajudar a lidar com a pandemia e prevenir futuros surtos".
Os voluntários receberão aleatoriamente doses de 100 microgramas de um placebo ou do fármaco, com o objetivo principal de comprovar se este é capaz prevenir os sintomas de covid-19, a infecção pelo coronavírus e os casos graves. Segundo a empresa, as primeiras doses foram aplicadas em Savannah, Geórgia, um dos mais de 70 locais de teste espalhados pelos Estados Unidos.
Os voluntários não saberão se estão recebendo a vacina real ou o placebo. Após duas doses, os cientistas acompanharão qual grupo foi mais infectado, à medida que os participantes sigam suas rotinas diárias, especialmente em áreas onde o vírus ainda está se alastrando descontroladamente.
A fase 3 de testes, com um número alto de voluntários, só foi possível graças a novos repasses de verbas do governo americano. No domingo, a Moderna anunciou em comunicado que conseguiu dobrar o financiamento governamental do projeto para US$ 955 milhões, modificando o contrato com a Autoridade de Pesquisa e Desenvolvimento Avançado de Biomedicina (Barda, na sigla em inglês) para ampliar em US$ 472 milhões a quantia inicial destinada ao desenvolvimento da vacina mRNA-1273.
"Após conversas com a Administração de Alimentos e Fármacos (FDA) e com a Operação Warp Seed nos últimos meses, a empresa decidiu executar uma terceira fase do teste clínico significativamente maior, fechando uma lacuna no financiamento da Barda graças a esta modificação no contrato", explicou a empresa.
A Moderna comunicou que, ao iniciar nesta segunda-feira a terceira fase do teste, dirigido pelo Instituto Nacional de Alergias e Doenças Infecciosas dos EUA, se torna a primeira empresa da corrida americana pela vacina a entrar nesta etapa avançada. Ela disse que continua a caminho de poder fornecer cerca de 500 milhões de doses da vacina em 2020, e possivelmente até 1 bilhão de doses por ano a partir de 2021.
Os Estados Unidos já registraram 4,2 milhões de casos de covid-19 e mais de 146 mil mortes, segundo estatística independente realizada pela Universidade Johns Hopkins.
Em todo o mundo, outras quatro candidatas à vacina estão na fase 3 de estudos clínicos: três da China e uma do Reino Unido de acordo com um balanço da Organização Mundial de Saúde (OMS).
Na terceira semana de julho, voluntários brasileiros começam a testar a vacina desenvolvida pela empresa chinesa Sinovac Biotech. Os primeiros 890 participantes receberam doses no Hospital das Clínicas da Faculdade de Medicina da USP, em parceria com o Instituto Butantan de São Paulo. Os pesquisadores do hospital vão analisar os voluntários a cada duas semanas, e estima-se que as primeiras análises estarão concluídas em até três meses. No total, participarão dessa fase 9 mil voluntários brasileiros, todos profissionais da saúde.
Além da vacina chinesa, o Brasil também está participando da fase 3 da vacina experimental desenvolvida pela Universidade de Oxford e a empresa farmacêutica AstraZeneca. De acordo com resultados preliminares divulgados recentemente, ela é segura e induziu resposta imunológica, segundo resultados preliminares divulgados na semana passada. A terceira fase de estudos clínicos, que inclui testes em 50 mil pessoas, está em andamento e inclui testes em 5 mil voluntários brasileiros, feitos em parceria com a Universidade Federal de São Paulo (Unifesp).
Fonte: DW
Comentários
Postar um comentário
Todas postagem é previamente analisada antes de ser publicada.